El potencial eléctrico de las membranas neuronales
La información procedente del medio ambiente, las órdenes y cualquier otro tipo de información son “traducidas” a un código usado por las neuronas para comunicarse entre sí y con otras células del organismo.
Este código nervioso está basado en 2 tipos de señales:
- – Señales eléctricas: se originan en las dendritas y en el soma (especializados en la recepción de información) y otras en el cono axónico siendo conducidas a lo largo del axón hasta los botones terminales.
- – Señales químicas: actúan como mediadoras en la transmisión de información a otras neuronas y células del organismo.Las neuronas se comunican básicamente de 2 formas:
- – Sinapsis eléctricas
- – Sinapsis químicas
El potencial électrico de las membranas
Todas las células (incluidas las neuronas) mantienen a través de sus membranas una diferencia de potencial eléctrico entre el interior y el exterior celular y sobre todo en el caso de las neuronas es fundamental para que la transmisión de información se produzca.
Esta diferencia de potencial o de carga eléctrica se debe a la diferente distribución de moléculas existentes a ambos lados de la membrana celular cada una de estas moléculas presenta una carga eléctrica (ion) que puede ser:
– positiva (catión)
– negativa (anión)
La distribución de estas moléculas cargadas eléctricamente determinará la cantidad de cargas positivas y negativas que se encuentran situadas a ambos lados de la membrana.
La diferencia de potencial no se produciría si las cargas eléctricas del ambos lados estuvieran compensadas (que cada lado tuviese igual cantidad de cargas positivas y negativas)
Al no existir esa compensación de cargas se establece dicha diferencia de potencial entre ambos lados de la membrana denominado potencial de membrana y representa la carga eléctrica o voltaje que se genera a través de esa membrana (Vm: voltaje de membrana), como consecuencia de la diferente distribución de cargas eléctricas a ambos lados de la misma.
Cuanto mayor es la diferencia de potencial entre el interior y el exterior, mayor carga eléctrica presenta la membrana.
En la distribución de las cargas eléctricas a ambos lados de la membrana se deben a los movimientos que experimentan diversos iones a través de la membrana hacia el interior y/o el exterior celular al verse afectados por 2 fuerzas:
- una de carácter químico que es la difusión
- otra de carácter eléctrico que actúa en función de la carga eléctrica del ion.
Fuerza de difusión: determina el movimiento de las partículas desde las regiones de mayor concentración hacia las regiones de menor concentración denominado movimiento a favor de gradiente.
Fuerza eléctrica o presión electrostática: ejerce una fuerza de repulsión entre partículas con la misma carga eléctrica y una fuerza de atracción entre cargas eléctricas de distinto signo.
El movimiento de una partícula a través de la membrana se puede ver afectado:
- Por un lado tanto por la fuerza eléctrica como por la química y se diría que depende del gradiente electroquímico.
- Por otro por la permeabilidad de la membrana a los diferentes iones/partículas, si la membrana no fuese permeable a los iones, éstos no podrían atravesarla a pesar de que el gradiente electroquímico les impulsara.
Canales iónicos: (proteínas especializadas) forman canales en la membrana que permiten el paso de iones a través de ella. La permeabilidad de la membrana aun determinado ion depende del número de canales iónicos abiertos que permiten el paso de ese ion a través de ella.
Bombas iónicas: (proteínas transportadoras insertadas en la membrana que influyen también en el movimiento de los iones a través de ella) transportan estas moléculas entre ambos lados de la membrana contra el gradiente de concentración, este tipo de transporte se llama transporte activo, lo que con lleva un gasto de energía que es proporcionada por la molécula de ATP (adenosín-trifosfato)
Potencial de reposo: es el potencial de membrana de la neurona cuando ésta se encuentra inactiva, en reposo.
Potencial de acción o impulso nervioso: (señal eléctrica básica que representa la transmisión de información en el SN) es el potencial de membrana de la neurona cuando ésta se encuentra activada y responde generando una señal eléctrica en su axón que es conducida hasta los botones terminales.
Excitabilidad: capacidad de las células para responder mediante este tipo de señales eléctricas, propiedad común de las neuronas pero también de otras células como las cardiacas o musculares.
El potencial de Reposo
En estado de repeso las neuronas presentan una diferencia de potencial a través de sus membranas de aproximadamente 60-70 mV (milivoltios) Este potencial refleja una desigualdad de la carga eléctrica a ambos lados de la membrana concentrándose:
– un exceso de cargas negativas en el interior celular
– un exceso de cargas positivas en el exterior celular
Por ello se dice que el potencial de reposo es negativo y se sitúa entre -60 y -70 mV.
Diferencias en las concentraciones de iones entre el interior y el exterior celular en estado de reposo
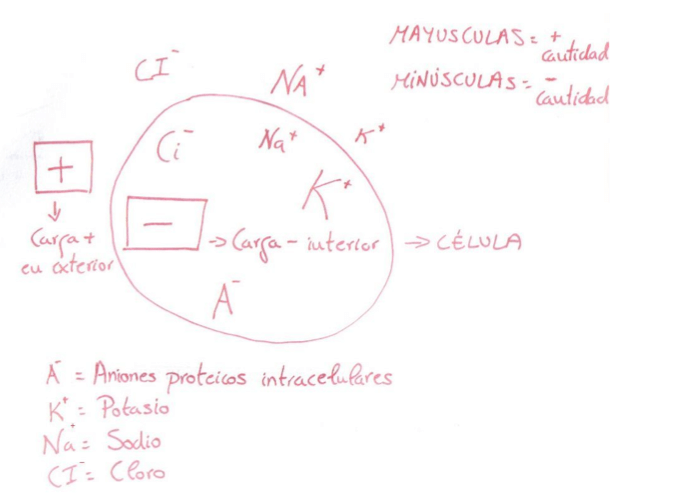
- – El catión que se encuentra en mayor concentración en el interior celular es el potasio (K+) mientras que en el exterior el ion positivo en mayor concentración es el sodio (Na+).
- – Los aniones más abundantes en el interior celular son moléculas proteicas orgánicas (A-) mientras que en el exterior celular es más abundante el cloro (CI-).
- – Hay una mayor concentración de iones K+ en el interior respecto al exterior mientras que el Na+ y el CI- están más concentrados en el exterior.
Al existir diferentes concentraciones de iones dentro y fuera de la célula, estos tienden a moverse por un lado a través de la fuerza eléctrica y por otro a través de la fuerza de difusión (explicado más arriba lo que son las diferentes fuerzas)
Existen diferencias en la permeabilidad de la membrana neuronal en estado de reposo a los distintos iones presentes en el interior y exterior celular.

- En estado de reposo la membrana es mucho más permeable al K+ que al Na+ (aunque no significa que sea totalmente permeable al K+)
- El grado de permeabilidad al CI- es intermedio respecto a los cationes mencionados (K+ y Na+)
- La membrana es impermeable a los aniones orgánicos intracelulares (A-) (estos siempre permanecen en el interior celular)
La principal corriente iónica que se produce en estado de reposo se debe al movimiento de los iones K+ debido a que en estado de reposo la membrana es más permeable al K+ que a otros iones.
El catión K+ es empujado hacia el exterior celular a favor del gradiente de concentración (debido a que está más concentrado en el interior celular que en el exterior K+ mayúscula del cutre-esquema 1) Consecuencia:
– Cada ion K+ que abandona la célula deja en el interior una carga negativa de más (ya no es equilibrada por la carga positiva del K+ que ha salido) y añade una carga positiva fuera de la neurona.
– Al mismo tiempo que cada ion K+ deja la célula y el interior celular se vuelve más negativo, la fuerza eléctrica empuja a los mismo iones K+ de nuevo hacia dentro (las cargas negativas en exceso del interior atraen a las cargas positivas del exterior)
– La tendencia a salir del K+ por difusión es contrarrestada por su tendencia a entrar empujado por la fuerza electrostática dándose una situación de equilibrio.
– El resultado final es la existencia de una diferencia de potencial eléctrico entre el exterior y el interior celular.
1. Bombas iónicas para el mantenimiento de las diferencias en las concentraciones de iones entre ambos lados de la membrana
La membrana en estado de reposo es prácticamente impermeable al Na+ pero sin embargo, algunos iones Na+ cruzan la membrana acumulándose progresivamente dentro de la célula.
La entrada de estas cargas positivas puede ser equilibrada mediante la salida de otras cargas positivas, como los iones K+ a los que la membrana es permeable.
Las diferencias en las concentraciones de ambos iones entre el interior y el exterior celular desaparecerían con el tiempo, por el movimiento de los iones K+ hacia el exterior celular y de los iones Na+ hacia el interior celular: la eliminación de esta diferenciación daría como resultado la eliminación de la diferencia de potencial en el interior y exterior por lo que la membrana neuronal sería incapaz de generar señales eléctricas y transmitir información.
La diferencia de de potencial se mantiene gracias a un mecanismo que se encarga de restablecer las diferencias de concentración entre ambos lados de la misma, este mecanismos está constituido por las bombas iónicas.
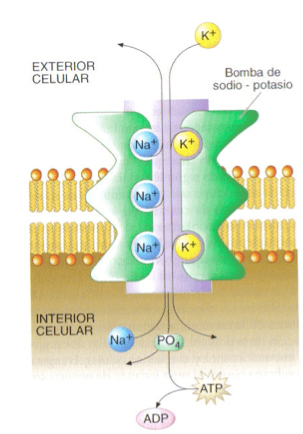
Bomba de sodio-potasio o ATPasa Na+/K+ o bombas electrogénicas (Figura 10.5): contribuyen a la creación de una diferencia de potencial a ambos lados de la membrana al expulsar al exterior 3 Na+ cargas positivas e impulsar hacia el interior únicamente 2 K+ por lo que queda en el interior una carga negativa sin equilibrar quedando así en el interior un exceso de cargas negativas.
Potencial de Acción
Hiperpolarización: El potencial de membrana puede volverse más negativo y adoptar un valor de por ejemplo -80 o -90 mV produciéndose una mayor diferencia en la distribución de las cargas eléctricas entre el interior y el exterior celular.
La Hiperpolarización hace que la neurona se vuelva todavía más inactiva y sea más difícil que pueda responder y transmitir información.
Despolarización: (lo contrario a lo anterior) la diferencia de potencial entre el interior y el exterior celular disminuya haciendo que el interior sea menos negativo y adopte valores de por ejemplo -50 o-20 mV.
La despolarización hace que aumente la probabilidad de que la neurona responda y pueda transmitir información, si se da este caso el potencial de membrana adopta un valor diferente al de potencial de reposo llamándose potencial de acción o impulso nervioso.
El potencial de acción:
- – se origina en el cono axónico (segmento del axón que se encuentra próximo al soma).
- – es una rápida inversión del potencial de membrana de forma que éste adopta un valor positivo de aproximadamente -50mV frente al valor negativo del potencial de reposo.
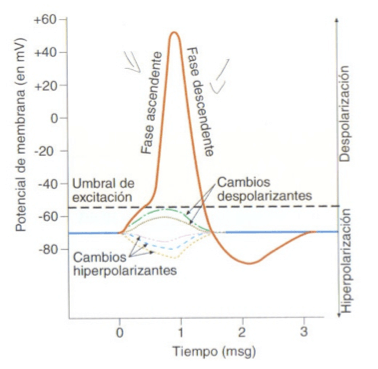
Para que se produzca la rápida inversión del potencial de membrana es necesario que se dé una despolarización inicial de una magnitud determinada, una magnitud de -55 mV así el potencial cambia súbitamente de forma que el interior de la neurona se vuelve positivo y el exterior negativo lo que indica que las cargas eléctricas se han distribuido de forma inversa respecto a la situación de reposo.
La magnitud de la despolarización es suficiente para que el potencial de membrana alcance el llamado umbral de excitación o potencial umbral que es el valor del potencial de membrana a partir del cual se dispara el potencial de acción.
Ley del todo o nada: el potencial de acción se produce si la despolarización es suficiente, si no, no se produce. Si se produce siempre conserva el mismo valor sin aumentar ni disminuir.
En la figura puede verse la fase de despolarización o fase ascendente que es cuando se produce la despolarización y rápida inversión del potencial de membrana hasta adoptar un valor positivo de aprox. +50mV tiene lugar aprox. en 1 milisegundo.
Tras este breve periodo se da la fase de repolarización o fase descendente donde decae rápidamente, de forma que aprox. otro milisegundo después, la diferencia de potencial se sitúa nuevamente en un valor negativo de aprox. -090mV retornando posteriormente al valor del potencial de reposo de -70mV.
Estos rápidos y súbitos cambios en el potencial de membrana respecto al potencial de reposo son los que constituyen un potencial de acción.
¿A qué pueden deberse estos cambios tan rápidos en la diferencia de potencial a través de la membrana neuronal?
Con el inicio de la despolarización la permeabilidad de la membrana a los iones Na+ aumenta, haciendo que pasen al interior celular más iones Na+ de los que entran en situación de reposo.
Esta mayor permeabilidad de la membrana neuronal a la entrada de Na+ durante la fase ascendente del potencial de acción se debe a la apertura de canales de Na+ que permanecían cerrados en estado de reposo.
Canales de Na+ dependientes de voltaje: se abren y se cierran según los cambios que experimenta el potencial de membrana.
Estos canales son sensibles a los cambios de voltaje a los cambios que experimenta el potencial de membrana y su apertura se da como consecuencia de que la despolarización inicial alcanza una magnitud necesaria para que el potencial de membrana llegue al umbral de excitación -55mV.
Además de la permeabilidad de la membrana a los iones Na+ en la fase ascendente del potencial de acción se produce un cambio en la permeabilidad a los iones K+ por la apertura de canales de K+.
Canales de K+ dependientes de voltaje: también responden a cambios en el potencial de membrana.
Difieren de los de Na+ en:
- – el tiempo de apertura y/o cierre desde el inicio de la despolarización.
- – que los canales de K+ dependientes de voltaje requieren para su apertura una mayor despolarización que los canales de Na+.
- – que su apertura se produces después de la apertura de los de Na+.La apertura de canales de K+ permite una mayor salida de iones K+ hacia el exterior celular de la que se producía en situación de reposo.
Durante la fase ascendente:
- – se da una entrada masiva de Na+ y una salida de K+ por la apertura de ambos canales dependientes de voltaje.
- – La cantidad de iones Na+ que entran es mucho mayor que la de iones K+ que salen.
- – El cambio en la proporción de iones que entran y salen se da cuando el potencial de membrana alcanza el umbral de excitación.
- – Si la despolarización inicial no es suficiente para que el potencial de membrana alcance el umbral, los iones Na+ pueden entrar tan rápidamente como los iones K+ salir. Por lo que el potencial de acción no se produce.
Estado de los canales de Na+ y K+ dependientes de voltaje durante el potencial de acción:
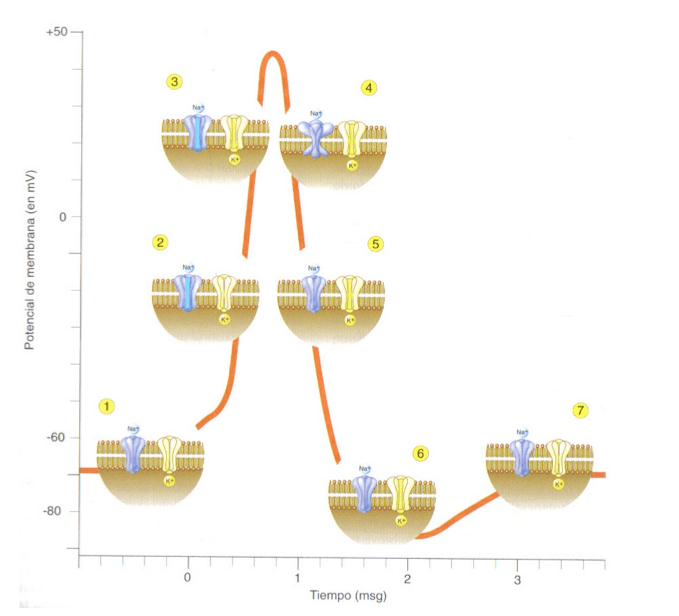
Explicación figura anterior:
Explicación de la figura 10.7:
- En estado de reposo, tanto los canales de Na+ como los de K+ permanecen cerrados.
- Cuando la despolarización inicial permite que el potencial de membrana alcance el umbral de excitación se abren los canales de Na+.
- Posteriormente, se abren también los canales de K+ que requieren una magnitud mayor de despolarización que los de Na+.
- Cuando se ha producido la rápida inversión del potencial de membrana y éste adopta un valor positivo de aprox. +50mV los canales de Na+ pasan al estado de inactivación mientras que los de K+ permanecen abiertos.
- Posteriormente, los canales de Na+ pasan del estado de inactivación al estado de cerrados, permaneciendo abiertos todavía los de K+.
- Durante un breve periodo, el potencial de membrana se encuentra hiperpolarizado.
- Vuelve poco tiempo después al valor característico del potencial de reposo cerrándose finalmente los canales de K+.
IMPORTANTE: Cuando los canales están cerrados pueden abrirse pero cuando están inactivos no pueden abrirse.
Al comienzo de la fase descendiente: los canales de Na+ están inactivos y no pueden ser abiertos y la neurona no puede generar un nuevo potencial de acción para responder a una nueva información, por lo que se dice que la membrana se encuentra en periodo refractario absoluto.
Al final de la fase descendiente: se produce una caída brutal hasta los -90mV antes de llegar al valor del potencial de reposo. Durante este breve periodo en que el potencial está hiperpolarizado la neurona es capaz de responder a una nueva información pero necesita una mayor magnitud de despolarización para generar el potencial de acción (unos 35mV desde donde estamos los -90 hasta los -55), por ello este periodo recibe el nombre de periodo refractario relativo.
1. Conductancias iónicas durante el potencial de acción
Conductancia: concepto que se emplea para describir el flujo de iones a través de la membrana. Depende no solo de la permeabilidad de la membrana sino también del número y de que éstos puedan moverse a través de la membrana.
Conductancias para los iones Na+ y k+ durante el potencial de acción:
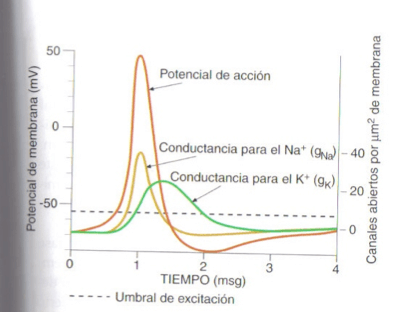
Durante el transcurso de un potencial de acción se producen cambios en las conductancias para los iones Na+ y K+ (Figura 10.8):
- – El aumento de la conductancia para los iones Na+ tiene lugar durante la fase de despolarización, siendo máxima aprox. 1 msg después del comienzo del potencial de acción.
- – La conductancia para los iones K+ empieza a aumentar también en la fase de despolarización pero con un cierto retraso respecto a la conductancia para lo Siones Na+, siendo máxima durante la fase de repolarización.
- – Cuando la conductancia para los iones K+ se restablece al nivel previo al potencial de acción, el potencial de membrana adopta el valor del potencial de reposo. La conductancia para el ion CI- no cambia durante la generación de un potencial de acción por lo que su conductancia no afecta a la producción del potencial de acción.
La propagación del potencial de acción
Propagación del potencial de acción: consiste en la conducción de esta señal eléctrica desde el cono axónico donde se origina hasta los pies terminales.
El potencial de acción a diferencia de otras señales eléctrica se regenera a lo largo del axón y esta capacidad de regeneración es independiente de la longitud del axón por lo que se dice que se propaga de forma activa.
La propagación del potencial de acción sólo se realiza en una dirección, desde el soma neuronal hasta el terminal presináptico se debe a que tras el disparo de un potencial de acción existe un periodo en el que la membrana neuronal es incapaz de responder con un nuevo potencial de accion (periodo refractario) por lo que solo puede ir hacia delante y nunca hacia atrás.
La refractariedad de la zona de membrana donde se ha producido el potencial de acción se debe a:
- – La inactivación de los canales de Na+ dependientes de voltaje
- – La hiperpolarización tras el disparo del potencial de acciónEstos 2 fenómenos son los responsables de que el potencial de acción se genere sólo hacia delante desde el cono axónico hasta los botones terminales.
Corrientes iónicas durante la propagación del potencial de acción en axones no mielinizados:

1. La conducción saltatoria
La forma en la que se propaga el potencial de acción presenta importantes diferencias en función de que el axón sea un axón mielinizado o no.
En los axones mielínicos o mielinizados, el potencial de acción no se regenera punto por punto de la membrana axonal como ocurre en los axones amielínicos, sino que el potencial de acción sólo se produce en los nódulos de ranvier (zonas del axón que quedan al descubierto sin mielina)
El potencial de acción “salta” de nódulo a nódulo, por lo que la propagación del potencial de acción en este tipo de axones recibe el nombre de conducción saltatoria.
A diferencia de los potenciales de acción, la magnitud de la despolarización que se da en el segmento mielinizado disminuye con la distancia y tiende a desaparecer por lo que se dice que son potenciales decrecientes.
Este tipo de señales no se regeneran sino que cada una de ellas se circunscribe al lugar en el que se origina (a un determinado segmento mielinizado) razón por la que también se denominan potenciales locales.
Frente a los potenciales de acción que se propagan de forma activa, estos potenciales decrecientes se propagan o conducen de forma pasiva, según las propiedad del axón (longitud, diámetro…)
A pesar de que estos potenciales locales disminuyen su magnitud con la distancia, la despolarización que llega al siguiente nódulo de ranvier es suficiente para que el potencial de membrana alcance el umbral de excitación y pueda disparar el potencial de acción.
Ventajas de la conducción saltatoria en los axones mielinizados:
- La velocidad de conducción del potencial de acción aumenta ya que éste sólo se genera en los nódulos y no a lo largo de toda la membrana axonal como en los axones amielínicos la mayor velocidad de conducción implica una mayor rapidez de respuesta.
- El ahorro de energía ya que el potencial de acción sólo se regenera en los nódulos, solamente en esa zona activa de la membrana hay canales iónicos de Na+ y K+ dependientes de voltaje.
Corrientes iónicas durante la propagación del potencial de acción en axones mielinizados:

Comunicación entre neuronas: Las Sinapsis
La transmisión de información se produce a través de contactos
funcionales a los que se denomina sinapsis.
En las sinapsis químicas: la comunicación entre neuronas se lleva a cabo mediante la liberación de un neurotransmisor desde los terminales o botones presinapticos.
La membrana celular de estos botones terminales es la membrana presinaptica y las neuronas que liberan estas sustancias se denominan neuronas presinapticas que son las que en un determinado momento transmiten la información a otras neuronas.
Las neuronas que en ese momento reciben la información se denominan neuronas postsinapticas y sus membranas, membranas postsinapticas. Pueden convertirse en neuronas presinapticas si a su vez transmiten información a otras.
El espacio extracelular que separa físicamente a las 2 neuronas que establecen contacto se denomina espacio o hendidura sináptica.
En las sinapsis eléctricas: las 2 células entran en estrecho contacto, de forma que los canales iónicos de sus membranas presináptica y postsináptica se juntan y permiten el paso de iones y otras moléculas pequeñas de una célula a otra. Las zonas de contacto se llaman uniones hendidas.
Sinapsis eléctricas: uniones hendidas
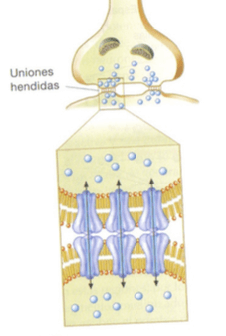
En la mayoría de las sinapsis eléctricas puede haber un flujo bidireccional de la información de forma que los cambios eléctricos que se dan en cualquiera de ellas afecta a la otra.
En otros casos la información es transmitida únicamente en una dirección, de modo que los cambios eléctricos que se dan en una de ella influyen sobre la otra, pero no a la inversa.
Una ventaja obvia de las sinapsis eléctricas es que no hay retraso en la transmisión de información. Las sinapsis eléctricas no sufren modificaciones de sus señales en respuesta a eventos que incidan sobre ellas, es una importante diferencia respecto a las sinapsis químicas, en las que las posibilidades de modulación de los mensajes son considerablemente mayores.
Las neuronas también se comunican entre si mediante otro tipo de transmisión que se denomina transmisión por volumen la transmisión de información se lleva a cabo gracias a la difusión de las sustancias neuroactivas en el volumen del fluido extracelular, alcanzando grupos de neuronas mas alejadas.
Los factores implicados en la difusión de las sustancias neuroactivas mediante el fluido extracelular no solo parecen ser diferentes en cada neurona, sino también entre diferentes regiones del SN central.
Estos factores de difusión también parecen modificarse en distintos estados fisiológicos, como ocurre durante el desarrollo, la lactancia y el envejecimiento.
También en diversos estados patológicos se producen cambios en la capacidad de difusión de diversos compuestos a través del fluido extracelular.
Las Sinapsis Químicas
Los neurotransmisores que se liberan durante la transmisión de información por medio de sinapsis químicas se encuentran almacenados en los botones terminales presinapticos en unos pequeños sacos de membrana que reciben el nombre de vesículas sinápticas.
En el sitio donde se produce la liberación las vesículas sinápticas se disponen muy agrupadas cerca de la membrana presinaptica, constituyendo las denominadas zonas activas.
Cuando los neurotransmisores son liberados se difunden a través del espacio o hendidura sináptica e interaccionan con proteínas especificas situadas en la membrana postsináptica que reciben el nombre de receptores postsinápticos.
1. Mecanismos de la Transmisión Sináptica Química
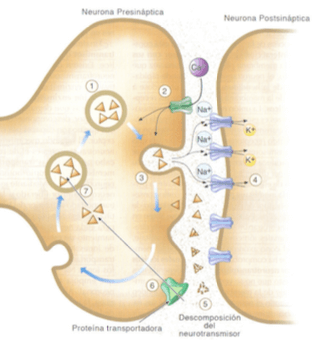
En la transmisión sináptica química tienen lugar 4 procesos o mecanismos principales
– En primer lugar: para que un neurotransmisor pueda ser liberado desde los botones terminales, es fundamental que la neurona disponga de los mecanismos que permiten su síntesis y almacenamiento en las vesículas sinápticas.
En algunos casos la síntesis se realiza en el soma neuronal desde donde es transportado hasta los botones terminales recorriendo todo el axon. En otros casos, el paso final de sus síntesis o su síntesis completa se lleva a cabo en los propios botones terminales.
– En segundo lugar: el segundo mecanismo de la transmisión sináptica consiste en la liberación del neurotransmisor. Para que esta liberación se de es fundamental que el potencial de acción llegue a los terminales presinapticos, que presentan, al igual que el axon, canales dependientes de voltaje, aunque en este caso los canales dejan pasar iones de calcio (Ca2+).
Cuando el potencial de acción alcanza los botones terminales se produce la despolarización de la membrana del terminal y la apertura de los canales de calcio. Los iones Ca2+ pasan al interior del terminal empujados por el gradiente electroquímico, al estar mas concentrados en el exterior celular y presenta el interior un exceso de cargas negativas1.
Una vez dentro de la neurona el calcio facilita la unión de las vesículas sinápticas a las zonas densas de la membrana presinaptica, lo que conduce a la fusión de las vesículas con la membrana del terminal para liberar su contenido a la hendidura sináptica.
– En tercer lugar: este proceso esta constituido por la interacción del neurotransmisor con sus receptores en la membrana postsináptica. El neurotransmisor se difunde rápidamente a través de la hendidura sináptica, uniéndose a unas proteínas de la membrana postsináptica: los receptores postsinápticos.
La unión es específica, de forma que cada molécula de neurotransmisor encaja perfectamente con su receptor, existiendo receptores diferentes para cada uno de los neurotransmisores.
La unión puede originar diferentes efectos en la neurona postsináptica como es el cambio en la permeabilidad de la membrana postsináptica debido a la apertura de canales iónicos y por el paso de iones a través de ellos. Estos canales iónicos se abren en respuesta a los neurotransmisores y son diferentes de los canales iónicos dependientes de voltaje.
Los canales iónicos controlados por neurotransmisores no son dependiente de voltaje puesto que no se ven afectados por los cambios en el voltaje de la membrana, solo responden cuando el neurotransmisor se une a sus receptores.
Ambos canales se caracterizan por abrirse de un modo todo o nada.
– En cuarto lugar: se da la inactivación del neurotransmisor que hace que la transmisión sináptica finalice. Existen 2 mecanismos mediante los que los neurotransmisores son inactivados:
- Uno es el de inactivación enzimática: se da por enzimas específicas que degradan o metabolizan cada neurotransmisor.
- Otro es el de recaptación: se da por proteínas transportadoras insertadas en la membrana del propio botón terminal que libera el neurotransmisor. Parte del neurotransmisor liberado a la hendidura sináptica es transportado al interior del botón terminal para ser reutilizado, es transportado junto con los iones Na+ gracias al gradiente de concentración.Existen proteínas transportadoras específicas para cada neurotransmisor.
Mecanismos principales que intervienen en la comunicación sináptica química.
2. Clases de Sinapsis Químicas
Las sinapsis químicas pueden clasificarse según:
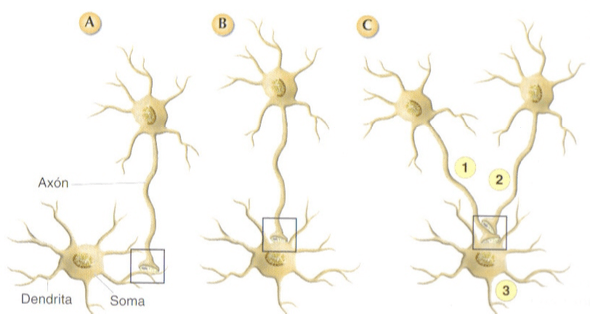
A. Las zonas de las neuronas que establecen contacto pueden ser:
- Sinapsis axodendriticas: aquellas que se establecen entre el axon de una neurona y las dendritas de otras, es el mas común en el SN.
- Sinapsis axosomaticas: el contacto sináptico puede establecerse también entre los axones de una neurona y el soma o cuerpo neuronal de otras.
- Sinapsis dentrodendríticas: son menos habituales y se establecen entre las dendritas de una neurona y las dendritas de otras.
- Sinapsis axoaxonicas: son contactos sinápticos entre los botones terminales de diferentes neuronas.
Sinapsis según las zonas de las neuronas que establecen el contacto.
B. Su morfología pueden ser:
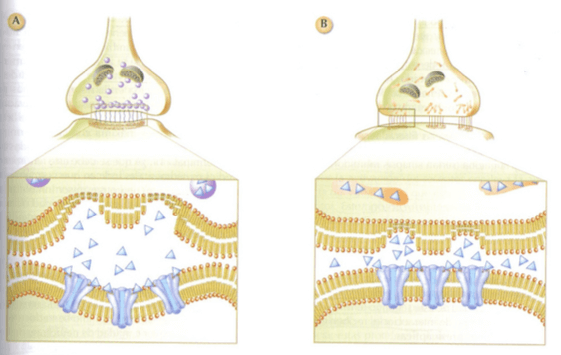
- Sinapsis tipo I: se produce la activación de la neurona postsináptica y son fundamentalmente sinapsis axodendriticas. Espacio sináptico amplio. Las estructuras están regularmente distribuidas.
- Sinapsis tipo II: se produce la inactivación de la neurona postsináptica y constituyen principalmente los contactos que se establecen en las sinapsis axosomaticas. Espacio sináptico menos amplio. Estructuras densas a lo largo de las membranas pre y postsináptica agrupándose en sitios concretos.La diferencia mas importante ente ambas es la morfología de las vesículas sinápticas. Se piensa que esta diferente morfología puede estar relacionada con el tipo de neurotransmisor liberado.
Sinapsis según su morfología
– Sinapsis axoaxonicas: inhibición y facilitación presinaptica
En algunas ocasiones un terminal presinaptico establece sinapsis sobre un segundo terminal presinaptico.
Estas interacciones ejercen un efecto inhibidor de la actividad de este segundo terminal a nivel presinaptico, este tipo de interacciones reciben el nombre de inhibiciones presinapticas.
Explicación: si se activa solamente el terminal 1 se produce una despolarización de la membrana de la neurona 3. Si se activa solamente el terminal 2 no se produce ningún tipo de cambio de potencial en esa neurona.
Por el contrario si se activan simultáneamente los 2 terminales, se observa que la magnitud de la despolarización producida en la neurona es más pequeña que la producida en respuesta a la activación únicamente del terminal 1.
¿A que se debe este fenómeno?
El terminal 2 libera un neurotransmisor inhibidor sobre el terminal1, disminuyendo la cantidad de neurotransmisor liberado por ese terminal y la consiguiente atenuación del efecto que produce en la neurona postsináptica.
El fenómeno contrario al de la inhibición presinaptica recibe el nombre de facilitación presinaptica.
Explicación: Se produce cuando el terminal 2 ejerce un efecto facilitador sobre el terminal 1, de forma que aumenta la entrada de iones Ca2+ al terminal. Se da la liberación de una mayor cantidad de neurotransmisor y una potenciación del efecto que el terminal 1 produce sobre la neurona postsináptica.
POTENCIALES POSTSINAPTICOS EXCITADORES E INHIBIDORES. LA INTEGRACION NEURAL.
La apertura de estos canales iónicos permite el paso de corrientes iónicas a través de la membrana, produciendo cambios en el potencial de la membrana postsináptica.
Estos cambios de potencial reciben el nombre de potenciales postsinápticos y pueden se de diferente naturaleza. Si el potencial de membrana se vuelve menos negativo (se produce una despolarización) estos potencial se denominan potenciales excitadores postsinápticos (PEPs).
Los neurotransmisores que producen este tipo de cambios del potencial de membrana son excitadores y las sinapsis donde se liberan estos neurotransmisores son sinapsis excitadoras.
Los PEPs NO garantizan el disparo de un potencial de acción, sino que únicamente aumentan la probabilidad de que este se produzca.
Si el potencial de la membrana postsináptica se vuelve mas negativo, (se produce una hiperpolarización) los cambios de potencial reciben el nombre de potenciales inhibidores postsinápticos (PIPs).
Los neurotransmisores que producen este tipo de cambios del potencial de membrana ejercen un efecto inhibidor y las sinapsis en las que son liberados son sinapsis inhibidoras.
Los PIPs NO evitan obligatoriamente la producción de un potencial de acción, sino que únicamente disminuyen la probabilidad de que este se produzca.
El hecho de que se produzca un PEPs o un PIPs en la membrana postsináptica depende del tipo de canales iónicos que se abren en respuesta a la activación del receptor:
- si la unión del neurotransmisor a sus receptores desencadena la apertura de canales para iones Na+ o iones Ca2+, los potenciales postsinápticos serán despolarizaciones (PEPs) de la membrana.
- por el contrario si los canales iónicos permiten el paso de iones K+ o iones CI-, se producirán hiperpolarizaciones de la membrana postsináptica (PIPs)
Un mismo neurotransmisor puede producir PEPs o PIPs en la membrana postsináptica dependiendo de los receptores a los que se une y de los canales iónicos que se abran.
En los canales iónicos controlados por neurotransmisores la activación del receptor conlleva la apertura directa del canal, dado que este, forma parte del propio receptor. Este tipo de receptores se llaman receptores ionotrópicos.
La activación del receptor pone en marcha una serie de mecanismos que pueden abrir canales iónicos de forma indirecta mediante cambios bioquímicos en el metabolismo intracelular de la neurona postsináptica, este tipo de receptores reciben el nombre de receptores metabotrópicos y sus efectos están mediados por unas proteínas insertadas en la membrana celular denominadas proteínas G.
Estas proteínas activan el metabolismo celular desencadenando una serie de reacciones bioquímicas en las que se producen moléculas mediadoras que reciben el nombre de segundos mensajeros (el primer mensajero es el neurotransmisor).
Uno de los segundos mensajeros mas conocidos es el AMPc (adenosin- monofosfato-cíclico), que puede desencadenar diversos efectos a nivel celular.
Otros sistemas de segundos mensajeros bien conocidos son el ion Ca2+, el GMPc (guanosina-monofosfato-cíclico), el inositol fosfato (IP3), el diacilglicerol (DG) y el acido araquidónico.
Los otros segundos mensajeros mencionados, al igual que el AMPC, requieren la activación previa de las proteínas G, que a su vez activan las enzimas implicadas en su síntesis.
Existen también receptores presinapticos llamados autorreceptores que están asociados igualmente a proteínas G y que se encuentran en el terminal presinaptico.
La unión de los neurotransmisores a estos receptores se realiza después de que los neurotransmisores hayan actuado sobre la neurona postsináptica.
La unión a los autorreceptores es un mecanismo de control de la síntesis del neurotransmisor que ha sido liberado.
Se sabe que la unión del neurotransmisor a sus receptores presinapticos activa, a través de las proteínas G, a sistemas de segundos mensajeros como el AMPc, el cual interrumpe o inhibe la síntesis del neurotransmisor.
Cuando se da un potencial de acción aunque la corriente fluya principalmente hacia el interior celular en cada contacto postsinápticos, también puede fluir hacia fuera de la célula a través de áreas de la membrana que no son canales propiamente dichos pero si zonas donde
hay canales difusos que participen en la permeabilidad natural que tienen las membranas neuronales a todo tipo de iones.
A causa de esta perdida de corriente, aunque los potenciales postsinápticos tienen cierta amplitud en el sitio donde han sido generados, van decayendo progresivamente a medida que se alejan de su punto de origen, por ellos los potenciales son potenciales locales, graduados o decrecientes, porque su magnitud disminuye gradualmente.
Este tipo de potenciales se propagan de forma pasiva según las propiedades de cable y aunque su magnitud disminuye según se van propagando por la membrana del soma y de las dendritas, muchos de estos potenciales locales alcanzan finalmente el cono axónico, produciéndose un proceso de integración de todas las señales, tanto excitadoras como inhibidoras, que recibe el nombre de integración neural.
En el cono axónico la neurona integra toda la información recibida de otras neuronas para emitir o no una respuesta:
- – Si la neurona responde se genera un potencial de acción en el cono axónico que será conducido hasta los botones terminales.
- – Si la neurona no responde, no dispara un potencial de acción, esque su potencia de membrana se encuentra hiperpolarizado o no se ha despolarizado lo suficiente para alcanzar el umbral de excitación.La integración neural consiste en un proceso de sumación de todos los potenciales locales que alcanzan el cono axónico, tanto de potenciales excitadores como inhibidores.
Los PEPs despolarizan la membrana, llevan al potencial de membrana por encima del valor del potencial de reposo, mientras que los PIPs hiperpolarizan la membrana, situando el potencial de membrana por debajo del potencial de reposo.Cuando se activan al mismo tiempo las sinapsis excitadoras aparece una despolarización global cuya magnitud es superior a cualquiera de los PEPs por separado. Este hecho se debe a que las despolarizaciones han sufrido un proceso de sumación.Cuando se generan PEPs sucesivos se suman a los anteriores, dando como resultado una magnitud de despolarización mayor que puede alcanzar el umbral de excitación y disparar un potencial de acción.El proceso de sumación tiene lugar simultáneamente en el plano espacial y en el plano temporal se produce una sumación de todos los potenciales locales que llegan al mismo lugar (sumación espacial) y al mismo tiempo (sumación temporal) como es bastante habitual en el SN.
Lo que ocurre cuando son activadas sinapsis inhibidoras es que los PIPs, al igual que los PEPS, son sumados cuando llegan al mismo tiempo y al mismo lugar en un proceso de sumación temporal y espacial, y cuanto mayor sea la magnitud de la hiperpolarización resultante de la suma, mas hiperpolarizado permanecerá el potencial de membrana del cono axónico, con lo que no podrá dispararse un potencial de acción.
Si se activan sinapsis excitadoras e inhibidoras al mismo tiempo, el proceso de sumación temporal y espacial afectara tanto a los PEPs como a los PIPs, de forma que se sumaran los cambios de potencial de membrana del mismo signo y se restaran los cambios de signo contrario los efectos despolarizantes de los PEPs se oponen a los efectos hiperpolarizantes de los PIPs.
Se puede dar el caso de que a pesar de la presencia de hiperpolarizaciones, la despolarización resultante del proceso de sumación sea suficiente para que el potencial de membrana alcance el umbral de excitación y pueda dispararse un potencial de acción el resultado neto del proceso de sumación de todas las señales locales que llegan al cono axónico, el que determina si se producirá o no el disparo del potencial de acción.
Algunas dendritas pueden generar potenciales de acción, debido a que presentan agrupaciones de canales sensibles a voltaje en determinados puntos de sus membranas.
Cuando se produce una despolarización suficiente, la membrana genera un pequeño potencial que sirve como amplificador de la pequeña despolarización resultante de la suma de los potenciales postsinápticos de todas las dendritas.
Se cree que esos potencial dendríticos son potenciales de acción producidos por la entrada de Na+ o de Ca2+, y que se generan en sitios estratégicos de neuronas con árboles dendríticos grandes, para asegurar que la información transmitida a través d esas sinapsis ejerce un efecto significativo en la respuesta neuronal.
Neutotransmisores y Neuromodularores
Algunos neurotransmisores abren canales iónicos directamente y otros activan proteínas G. A estos últimos se les llama también neuromoduladores porque modulan la eficacia de los potenciales postsinápticos producidos en los receptores asociados a canales iónicos.
No producen directamente potenciales postsinápticos, pero son capaces de regular la mayor o menos actividad de los canales iónicos asociados a receptores ionotrópicos.
Esta modulación se realiza mediante la activación de proteínas G, lo que produce una serie de reacciones bioquímicas que pueden conducir indirectamente a la apertura o el cierre de canales iónicos.
Todos aquellos neurotransmisores que actúen sobre neuronas postsinápticas mediante receptores metabotrópicos deben ser considerados mas apropiadamente como neuromoduladores.
La neuromodulación es un mecanismo de gran relevancia en el SN pues permite la amplificación de señales en un momento dado:
- una molécula de neurotransmisor que se une a receptores ligados a canales iónicos abre un solo canal.
- cuando una molécula de un neuromodulador activa a un receptor asociado a proteínas G puede activar indirectamente a muchos canales iónicos distintos de forma simultánea.
Un mismo neurotransmisor puede actuar como neurotransmisor propiamente dicho en unas sinapsis, si se une a receptores con canales iónicos asociados y como neuromodulador en otras, si se une a receptores ligados a proteínas G.
Hay diferencias respecto al tiempo de inicio de las acciones de estas sustancias neuroactivas cuando funcionan como neurotransmisores o como neuromoduladores.
Los neurotransmisores producen efectos rápidos, mientras que los de los neuromoduladores son más lentos. El efecto de un neurotransmisor es de entre 10 y 100 msg. Por el contrario, los efectos mediados por los neuromoduladores normalmente tardan mas en manifestarse del orden de segundos y su duración puede llegar al orden de minutos, horas o incluso mas.
Se piensa que los cambios lentos, a largo plazo, que se producen en la actividad neural están regulados por neuromoduladores.
Morfológicamente, las vesículas que contienen neurotransmisores o neuromoduladores son también diferentes.
Hay botones terminales donde coexisten dos o más neurotransmisores y a menudo uno de ellos se comporta como un neurotransmisor y el otro como un neuromodulador.
1. Clases de Neurotransmisores y Neuromoduladores
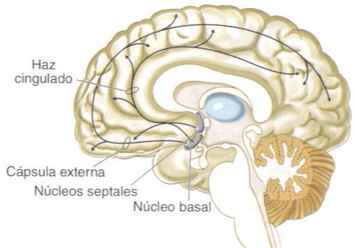
– Acetilcolina (ACh) se encuentra tanto en el SN central como en el Sn periférico, es el neurotransmisor de la unión neuromuscular (sinapsis entre neuronas y fibras musculares), de las sinapsis que se establecen en los ganglios del SN autónomo, tanto del SN simpático como del parasimpático, así como de las sinapsis del SN para simpático con sus células diana.
Se sintetiza en mayor cantidad en algunos núcleos del encéfalo anterior como los núcleos septales y los núcleos basales de Meynert, desde donde se envían proyecciones a todo el encéfalo.
Distribución de las vías nerviosas colinérgicas.
La acetilcolina se comporta como un neurotransmisor excitador pero también puede ejercer el efecto contrario, un efecto inhibidor.
Los receptores a los que se une la acetilcolina se denominan receptores colinérgicos, existiendo 2 subtipos diferentes:
A. los receptores muscarínicos B. los receptores nicotínicos
La caracterización bioquímica de los receptores colinérgicos es que están constituidos por una proteína con 5 subunidades que forman el canal iónico que permite el paso de iones a través de la membrana.
– Aminas biogénas pueden distinguirse 2 subclases:
A. Catecolaminas son 3: dopamina, noradrenalina (o norepinefrina) y la adrenalina (o epinefrina).
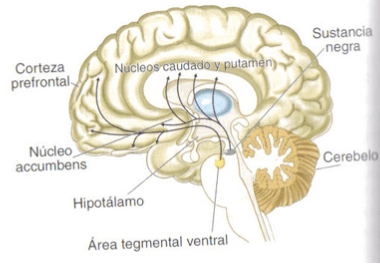
La Dopamina (DA) se sintetiza fundamentalmente en los cuerpos neuronales del área tegmental ventral y de la sustancia negra, ambas situadas en el tronco del encéfalo. Desde estas regiones se envían proyecciones dopaminérgicas hacia diferentes partes del SN, principalmente hacia el encéfalo anterior.
Distribución de las vías nerviosas dopaminérgicas.
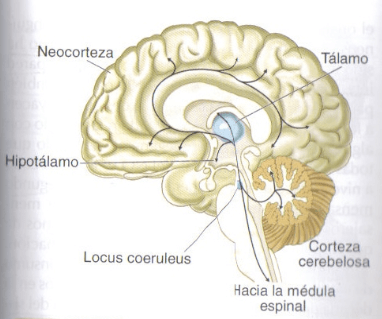
La Noradrenalina (NA) se sintetiza principalmente en el locus coeruleus, situado en el tronco del encéfalo, desde donde parten proyecciones noradrenérgicas que se distribuyen ampliamente por todo el encéfalo.
Distribución de las vías nerviosas noradrenérgicas.
La Adrenalina se sintetiza a partir de la noradrenalina en los botones terminales de las neuronas del SNC y también es sintetizada en la medula adrenal.
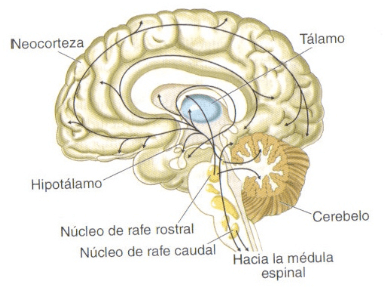
B. Serotonina (5-HT) se sintetiza fundamentalmente en los núcleos del rafe del tronco del encéfalo, desde donde se envían proyecciones serotoninérgicas a diversas regiones del SN central y de la medula espinal.
Distribución de las vías nerviosas serotoninérgicas.
Se conocen 5 subtipos diferentes de receptores dopaminérgicos, 5 noradrenérgicos y 7 serotoninérgicos. La mayoría de estos receptores son metabotrópicos.
Se piensa que las aminas biógenas desempeñan una importante función en la regulación de los estados afectivos y de la función cerebral.
– Aminoácidos transmisores son los principales neurotransmisores excitadores e inhibidores del SN y participan en la mayoría de las sinapsis del SN, a través de receptores ionotrópicos.
Entre los aminoácidos excitadores se encuentran: el glutamato y el aspartato.
Entre los inhibidores están: el acido gamma-aminobutírico (GABA) y la glicina.
Desde un punto de vista químico, estos 4 aminoácidos son muy parecidos y se sintetizan mediante diferentes reacciones químicas a partir del glutamato.
El glutamato, el aspartato y la glicina participan en numerosas funciones celulares, además de ser neurotransmisores y solo el GABA es exclusivamente neurotransmisor.
También hay diferentes subtipos de receptores para los aminoácidos transmisores ejemplo: los principales receptores del GABA son los receptores GABA-A y GABA-B y los del glutamato son NMDA (N-metil D- aspartato) y AMPA.
La activación de los receptores AMPA y sobre todo del NMDA parece desempeñar una importante función en la mediación de procesos relacionados con la memoria y la muerte neuronal que se da en algunas enfermedades neurodegenerativas como la del Alzheimer.
– Los Neuropéptidos están constituidos por cadenas de aminoácidos. Se localizan tanto en el SN como en los tejidos periféricos y pueden comportarse como neurotransmisores y/o neuromoduladores.
A este grupo pertenecen las hormonas del sistema neuroendocrino, además de desempeñar funciones muy variadas en el organismo, actúan también como neuromoduladores en el SN.
Se almacenan en vesículas y se unen a receptores específicos en las células diana que en la mayoría de los casos están acoplados a proteínas G.
En algunos terminales nerviosos de la misma neurona puede predominar mas la liberación de un neurotransmisor, mientras que en otros terminales se produce una mayor liberación del otro neurotransmisor o Neuropéptidos colocalizado con el.
Ejemplo: Participan en el control de dolor, en la regulación de la temperatura, del sueño y de la actividad del sistema inmune, en las respuestas del organismos a situaciones estresantes, en la regulación de la ingesta de comida y de bebida, de la conducta sexual, así como en procesos complejos como el aprendizaje y la memoria.
Existencia en el SNC de los péptidos opioides endógenos que se unen a receptores específicos ampliamente distribuidos por todo el SNC. Existen diversos tipos de receptores opioides que están acoplados a proteínas G: son los denominados receptores mu, delta y kappa.
Otro grupo de compuestos usados por las neuronas para comunicarse entre si esta constituido por algunos gases solubles como el oxido nítrico (NO) y el monóxido de carbono (CO).
Estos compuestos se producen en las neuronas, aunque no son exclusivos de estas, y en su presencia se estimula la síntesis del segundo mensajero CMPC.
El NO y el CO atraviesan las membranas neuronales y se difunden por el espacio extracelular pudiendo alcanzar a grupos de neuronas vecinas y actuar sobre ellas sin que haya receptores definidos en sus membranas, por lo que se les considera mensajeros transcelulares.
El NO participa en una gran diversidad de funciones en el organismo, como la dilatación de los vasos sanguíneos cerebrales en las regiones cuyo metabolismo ha sido actividad, el control de los músculos de la pared intestinal o la erección del pene. También participan en los cambios neuroplásticos que subyacen a los procesos de aprendizaje y ha sido relacionado con algunas enfermedades neurodegenerativas.
El No es considerado también un segundo mensajero.
La existencia del sistema cannabinoide endógeno esta constituido por receptores específicos y por ligandos que se unen a estos receptores. Hay 2 tipos de receptores para cannabinoides que se denominan CB1 y CB2, con una diferente distribución en el organismo:
- – Los receptores CB1 se localizan principalmente en el SNC, en los terminales nerviosos periféricos y en diversos órganos internos como los testículos o el corazón.
- – Los receptores CB2 en el SNC pero su presencia en el parece estar mas restringida, encontrándose fundamentalmente en las células y tejidos relacionados con el sistema inmune.El descubrimiento de receptores para cannabinoides sugirió la existencia de ligandos endógenos, conocidos con el nombre de endocannabinoides capaces de unirse a ellos y desencadenar diversas respuestas fisiológicas.El primer ligando endocannabinoide fue la anandamida, un compuesto lipídico que se une de forma preferente a los receptores CB1 y su activación produce entre otros efectos la inhibición de la síntesis del segundo mensajero AMPc
Es importante el papel del sistema cannabinoide endógeno en la regulación de la función endocrina, de la ingesta de comida y del balance energético corporal, en la modulación de la nocicepcion, las conductas reproductoras, el estado emocional y en procesos cognitivos como el aprendizaje y la memoria.
Farmacología de la Sinapsis Química
En la síntesis y el almacenamiento de los neurotransmisores existen diversas sustancias químicas que pueden afectar a estos 2 procesos.
Ejemplo en la síntesis: la AMPT interfiere la síntesis de catecolaminas al unirse a la enzima tirosinahidroxilasa que convierte la sustancia precursora tirosina en L-DOPA que es un paso intermedio en la producción de DA y NA.
Ejemplo en el almacenamiento: algunas sustancias psicoactivas, como la reserpina, impiden el almacenamiento de aminas e las vesículas, con lo que estos neurotransmisores quedan desprotegido dentro de los terminales nerviosos y expuestos a la degradación por parte de las enzimas allí presentes (como las monoaminooxidasas, MAO). Los neurotransmisores son destruidos y no pueden ser liberados.
En el proceso de liberación del neurotransmisor también existen otras sustancias que también afectan.
Una forma de disminuir la efectividad del CA2+ es elevar las concentraciones extracelulares de magnesio o de cobalto, que son iones que pueden competir con el CA2+ para entrar en la célula.
Otras sustancias químicas pueden estimular la liberación del neurotransmisor. Ejemplo: el veneno de la viuda negra. Esta sustancia estimula la liberación continua de acetilcolina hasta agotar los depósitos de este neurotransmisor. La acetilcolina es el neurotransmisor de la unión neuromuscular y de una gran parte de las sinapsis del SN autónomo.
Otras sustancias psicoactivas actúan en los receptores postsinápticos. Se conocen numerosos compuestos que, al unirse a receptores específicos, impiden la unión del neurotransmisor y por tanto el efecto que este produce.
A este tipo de sustancias se les denomina antagonistas. Existen 2 tipos de antagonismo:
– antagonismo irreversible: la sustancia se une tan fuertemente al receptor que prácticamente llega a destruirlo.
– antagonismo reversible: caracterizado porque la sustancia bloqueante se va separando del receptor según transcurre el tiempo.
Las sustancias que se unen a los receptores imitando la acción del neurotransmisor reciben el nombre de agonistas. La muscarina y la nicotina son agonistas de los receptores muscarinicos y nicotínicos de la acetilcolina, respectivamente.
Si la sustancia facilita la liberación del neurotransmisor se comportaría como un agonista y si impide la síntesis del neurotransmisor se comportaría como un antagonista.
En la inactivación del neurotransmisor, todas aquellas sustancias que afectan a las enzimas que participan en la degradación del neurotransmisor o a su recaptación por parte del terminal presinaptico modifican la transmisión sináptica. Cualquier compuesto que inhiba estos dos procesos, potenciara el efecto de los neurotransmisores.

