El desarrollo del Sistema Nervioso es un proceso muy complejo que se inicia en las primeras semanas de la vida embrionaria, cuando algunas células del embrión quedan determinadas para formar el tejido nervioso.
El Sistema Nervioso, al igual que la piel, se desarrolla a partir del ectodermo, que es una de las tres capas embrionarias al inicio de la gestación.
El proceso de desarrollo del Sistema Nervioso se lleva a cabo en diversas fases durante las que el Sistema Nervioso es una estructura extremadamente dinámica, con una gran capacidad de cambio.
Cada una de las fases del proceso requiere una gran precisión y de su correcta ejecución depende la organización y el funcionamiento posterior del Sistema Nervioso.
Marcando el Desarrollo del Sistema Nervioso: Neurulación del Embrión
Morfogénesis del individuo: proceso general de la adquisición de la forma y características generales de la especie. Este proceso comienza en la fecundación con la formación del cigoto, que da paso al desarrollo embrionario-fetal.
La morfogénesis del Sistema Nervioso comienza en un periodo muy temprano de la vida (3ª semana embrionaria). Anterior a esto el embrión es un disco formado por 2 capas de células (epiblasto e hipoblasto).
Gastrulación: Es una fase embrionaria que se inicia al comienzo de la 3ª semana en la que se forman las capas embrionarias de las que se desarrollarán todos los órganos corporales, incluido el SN. Este proceso se inicia al producirse una invaginación (el nódulo primitivo y la línea primitiva) en la parte dorsal del disco embrionario dando paso a una gran movilización de células hacia el interior del disco.
Consecuencia de la movilización: Se forma una capa embrionaria intermedia por lo que el disco embrionario pasa a estar formado por 3 capas (Figura 8.1):
– Endodermo: es la capa más interna del disco embrionario y de sus células se originan el sistema digestivo, respiratorio y algunas glándulas.
– Mesodermo: es la capa intermedia y de ella derivan los tejidos cartilaginoso, óseo y muscular, la dermis de la piel, el corazón, los vasos y las células sanguíneas, los riñones y el sistema reproductor.
– Ectodermo: es la capa más externa del disco embrionario y de él derivan la epidermis de la piel y el SN
Entre estas 3 capas embrionarias se establece una gran interacción y a partir de ellas comienzan a desarrollarse todas las estructuras del organismo.

Neurulación del embrión: proceso mediante el cual el SN se origina del ectodermo. Consiste en que una parte del ectodermo queda determinada como tejido neural y se forman las primeras estructuras neurales embrionarias.
Este proceso tiene 2 pasos consecutivos:
- – La inducción neural, en este primer paso se marca el territorio neural del ectodermo.
- – Se forman las estructuras neurales iniciales (tubo neural y cresta neural) a partir de las cuales se desarrollarán todas las que configuran el SN.
El Comienzo es la Inducción Neural del Ectodermo
Inducción Neural: consiste en que una parte del ectodermo queda determinada como tejido del que se originará el SN, es decir, como neuroectodermo.
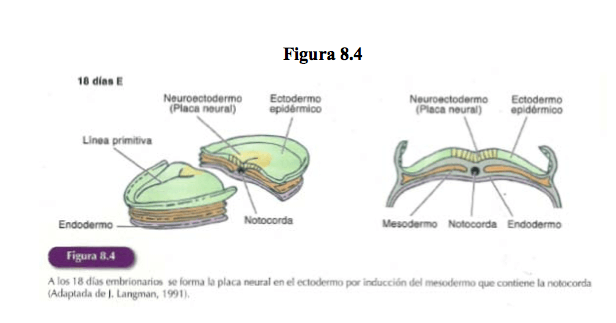
Este proceso tiene lugar cuando en el mesodermo se forma la notocorda: prolongación precursora de la columna vertebral que define el eje céfalo-caudal del embrión (Figura 8.1), la cual establece con el ectodermo una intensa interacción fundamental para el proceso de la inducción neural.
Los datos apuntan a que, la parte del mesodermo que contiene la notocorda envía unas señales inductoras al ectodermo desencadenando su diferenciación como neuroectodermo (modelo más sólido actualmente).
Investigaciones de Spemann, propone que: En el desarrollo normal del embrión el mesodermo va a provocar la inducción neural de una parte del ectodermo mediante señales inductoras y el resto del ectodermo, al no recibir estas señales, se desarrolla como tejido epidérmico (piel) y no como SN.
Pero, en los últimos 20 años se ha perfilado un modelo de acción de las señales inductoras neurales que es algo más complejo que el propuesto por Spemann. Se considera que:
La primera acción del mesodermo está dirigida por unas moléculas (las proteínas morfogenéticas óseas) que promueven la diferenciación del ectodermo en tejido epidérmico, al mismo tiempo que inhiben activamente su determinación neural. Esta inhibición hace que para que se produzca la inducción neural deban actuar (ahora sí) las señales inductoras que neutralizarán las proteínas indicadas promoviendo así la determinación neural del ectodermo.
Otra explicación alternativa: El destino del ectodermo, por defecto, es desarrollarse como neuroectodermo, y el hecho de que esto no sea así se debe a que actúan señales inhibitorias que impiden la neurulación de una parte del ectodermo y lo convierten en tejido epidérmico.
De cualquier modo, lo esencial es que, con la inducción neural se establecen los límites del neuroectodermo.
Seguidamente, en este proceso de interacción, el mesodermo promueve la proliferación (el nacimiento de las células por mitosis sucesivas) de las células del neuroectodermo formándose una placa neural más gruesa en la superficie dorsal media del disco embrionario (18 días embrionarios – 18E). (Figura 8.4). Esta placa es la precursora del SN, sus células han quedado determinadas para desarrollarse como células nerviosas y formarán tejido nervioso.
Además, en esta primera fase de la neurulación se produce la regionalización (identidad a las distintas regiones, quedan determinadas para formar un determinado tejido nervioso) de la placa neural. Tras esta regionalización la placa sigue su proceso de cambio.
2º paso de la neurulación: consiste en transformar la placa neural en 2 estructuras:
- Tubo neural
- Cresta neural
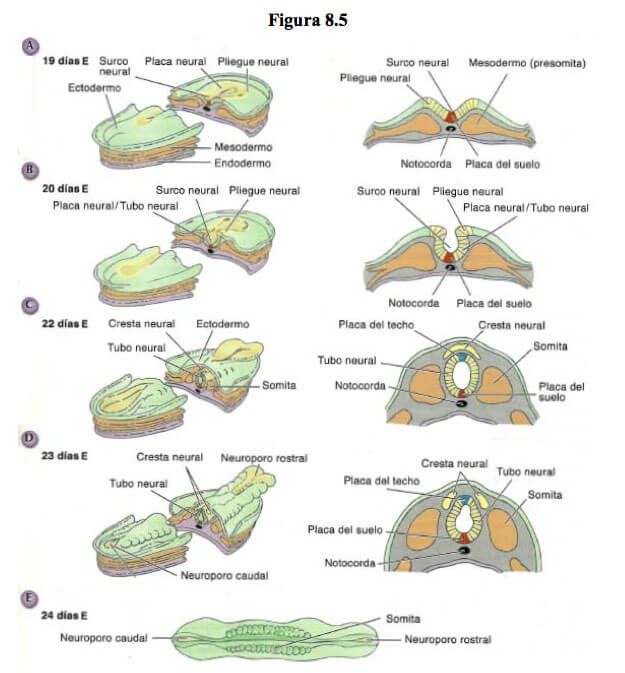
Este proceso comienza cuando la placa neural se pliega sobre sí misma y aparece en la línea media un surco neural flanqueado por 2 pliegues.
Estos pliegues neurales se fusionan en la zona medial de la placa y van cerrando el surco formando un tubo neural hueco.
Las aperturas transitorias (neuroporos rostral y caudal) al final de la 4ta semana desaparecen porque el tubo neural ha terminado de fusionarse completamente. El cierre de los neuroporos es una fase muy importante el desarrollo del embrión porque si no se realiza correctamente se producen una gran variedad de malformaciones congénitas.
– Fallo en el cierre del neuropopro caudal: produce malformaciones en la médula espinal, denominadas malformaciones de espina bífica
– Fallo en el cierre del neuroporo rostral: produce malformaciones en el encéfalo (anencefalia) y en el cráneo, que queda escindido.
Las alteraciones en el cierre del tubo neural pueden ser debidas a mutaciones genéticas o a la intervención de factores ambientales que alteran el proceso de inducción y/o fusión del tubo.
Al cerrarse el tubo neural, la parte externa de cada pliegue neural se separa del tubo y del ectodermo adyacente. Estas dos zonas escindidas de los pliegues neurales se fusionan y forman una estructura que se denomina cresta neural (Figura 8.5C). La cresta se sitúa entre el tubo neural y el ectodermo, ocupando una posición, primero dorsal y después lateral al tubo neural.

Se establecen los límites: Formación de las divisiones del sistema nervioso
En el curso del desarrollo del tubo neural se van a originar todas las neuronas y las células gliales que formarán el SNC, mientras que en la cresta neural se originarán, además de otras, las células del SNP. Este proceso se lleva a cabo por la sucesión de una serie de fases, denominadas fases del desarrollo.
Desarrollo del Tubo Neural: se forman las vesículas encefálicas
Las divisiones del SNC comienzan a esbozarse en un periodo muy temprano del desarrollo. A partir de que se cierra el neuroporo rostral se inicia un periodo de transformación rápida del tubo neural en el que se esbozan la forma y los límites de las diferentes divisiones del SNC.

El proceso de transformación comienza con la dilatación del tubo neural en la región cefálica.

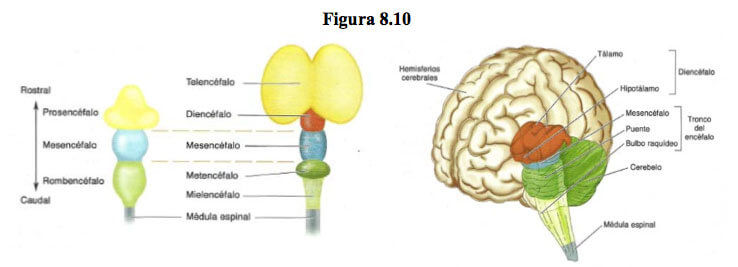
Al final de la 4ª semana el tubo neural se ha empezado a curvar por las flexiones mesencefálica y cervical y se aprecian 3 vesículas en esta regiónel prosencéfalo, el mesencéfalo y el rombencéfalo.
Lámina terminal: limite anterior del tubo neural en este periodo.
- En el prosencéfalo se distinguen ya 2 abultamientos laterales que son las vesículas ópticas.
- En el rombencéfalo se extiende la zona caudal del tubo neural (la futura medula espinal).
En la 5ª semana
– El prosencéfalo se divide en 2 vesículas:
• Telencéfalo (anterior): se esbozan los hemisferios cerebrales al formarse 2 vesículas laterales que sobrepasan la lámina terminal.
• Diencéfalo (entre) se denomina así porque está situada entre el telencéfalo y el mesencéfalo.
– En esta semana el mesencéfalo permanece como una única vesícula.
– En el rombencéfalo se producen varias trasformaciones:
- se establece el límite con el mesencéfalo al formarse el istmo
- el rombencéfalo se divide en 2 vesículas:1. Metencéfalo (más allá de): se forma la flexión pontina que plegará el metencéfalo hacia atrás contra el mielencéfalo
2. Mielencéfalo (médula)
El interior hueco del tubo neural a lo largo de las vesículas cefálicas y de la zona caudal (médula espinal) configura las cavidades del futuro sistema ventricular (ventrículos encefálicos y canal de la médula espinal) (Figura 8.6
El tubo neural se segmenta: factores que establecen los límites
En las primeras semanas del desarrollo embrionario humano, el tubo neural presenta un patrón característico de segmentación:
Las vesículas anteriores están divididas en segmentos llamados neurómeros, que desaparecerán en el desarrollo posterior.
En el romboencéfalo se delimitan una serie de segmentos abultados llamados rombómeros (Figura 8.7): son como unidades repetidas pero con identidad propia, marcados por el patrón regular de entradas y salidas de los nervios craneales.
Esta segmentación también es evidente en la zona caudal del tubo neural en la que comienzan a formarse los ganglios espinales.

Esta segmentación, en el eje antero-posterior es continuación del proceso de regionalización y está dirigida por la expresión de genes homeóticos que progresivamente van marcando la identidad de las distintas regiones del encéfalo embironario. Estos genes, denominados genes homeobox o genes Hox, se expresan en el tubo neural en el mismo orden lineal en el que están en los cromosomas y cuyo patrón espacial de expresión establece que cada rombómeros es un compartimento repetido, pero separado de los adyacentes y con identidad propia.
La expresión de los genes Hox en los rombómeros: está relacionada con la diferenciación de las neuronas reticulares y las neuronas de los núcleos sensoriales y motores de los nervios craneales. Esta expresión, no solo han de seguir un patrón espacial adecuado, sino también un adecuado ritmo temporal; porque si se producen alteraciones espacio-temporales aparecen malformaciones en el desarrollo del SN.
Se establece el Patrón Dorso-Ventral en el tubo neural: regionalización funcional
Se establece en gran parte de la extensión del tubo neural un patrón dorso-ventral, que diferencia y separa las células que llevarán a cabo funciones sensoriales de las que intervendrán en la coordinación motora.
Este patrón determina que las células que van a desempeñar funciones motoras ocupen una posición ventral en el tubo neural y que las que se ocuparán de funciones sensoriales se ubiquen en posición dorsal.

El patrón dorso-ventral también se establece por mecanismos de inducción. (Figura 8.8): las señales inductoras dorsalizantes provienen del ectodermo dorsal a la cresta neural e inducen la diferenciación de la placa alar (techo) de las células que intervendrán en la coordinación sensorial y de la cresta neural, mientras que las señales inductoras ventralizantes provienen de la notocorda e inducen la diferenciación de la placa basal (desde el diencéfalo hasta la médula espinal) de las células que intervendrán en la coordinación motora.
Surco limitante: separa las placas alar y basal.
Las 5 vesículas segmentadas originan las divisiones y estructuras del SNC
A las 5 semanas un embrión humano tiene 5 vesículas encefálicas y una prolongación caudal del tubo neural, que se han segmentado y han adquirido una regionalización funcional general (dorsal: sensorial – ventral: motora)
En las próximas semanas del desarrollo, las células de la pared de estas vesículas y de la zona caudal del tubo neural llevarán a cabo un acelerado proceso de división y la pared se irá engrosando. Se produce un crecimiento diferencial (no homogéneo) en las diferentes zonas, lo que provocará la aparición secuencial de las diversas estructuras que forman las distintas divisiones del SNC maduro.
El engrosamiento de la pared de las distintas vesículas provocará la formación de las divisiones del encéfalo y sus distintas estructuras.
- – En el telencéfalo de los hemisferios cerebrales primitivos se formarán la corteza cerebral y las estructuras subcorticales.
- – En el diencéfalo se formarán sus 4 componentes: tálamo, hipotálamo, subtálamo y epitálamo.
- – En el mesencéfalo se formarán los colículos.
- – El posterior desarrollo de la zona dorsal del mesencéfalo con influencia del mesencéfalo adyacente provocará eldesarrollo del cerebelo.
- – En la zona ventral del mesencéfalo se desarrollarán las estructuras del puente.
- – El mielencéfalo formará el bulbo raquídeo.
- – El engrosamiento de la zona caudal del tubo neural provocará la formación de la médula espinal.
Desarrollo de la Cresta Neural: formación del SNP
La cresta neural, que se extiende desde la vesícula diencefálica hasta el extremo caudal del tubo neural, es la que origina el SNP.
Al comienzo de su desarrollo se sitúa dorsal al tubo neural y después se parte en 2 mitades que se colocan a cada lado del tubo en interacción con el mesodermo subyacente.
El mesodermo que bordea el tubo neural está segmentado en bloques llamados somitas: unidades precursoras de la musculatura axial y del esqueleto.
A partir de la 4ª-5ª semana las células de la cresta neural, agrupadas junto a los somitas a ambos lados de la región caudal del tubo neural, formarán los ganglios espinales que se localizarán a intervalos regulares (marcados por los somitas) a lo largo de la región caudal del tubo neural.
Esta organización segmentada (1o somitas – 2o ganglios espinales) establece la organización segmentada madura de la médula espinal.
Hacia la 6ª semana del desarrollo se producirá la unión entre estos ganglios periféricos derivados de la cresta neural y la médula espinal, comenzando a adquirir su organización madura característica.

Las células de los ganglios espinales, situadas en el margen dorso-lateral de la médula espinal, empiezan a extender 2 prolongaciones:
– una hacia la periferia (centrífuga). Las prolongaciones centrífugas se unen a los axones en crecimiento de las células del asta ventral de la médula espinal que se dirigen hacia los somitas y juntos forman los nervios espinales.
– otra central (centrípeta) que se dirige hacia el asta dorsal de la médula espinal. Las prolongaciones centrípetas forman las raíces dorsales de los nervios espinales.
La formación de los ganglios craneales no parece depender de la interacción con el mesodermo, pero al igual que la de los ganglios del SN autónomo, siguen procesos similares a los que se producen en los ganglios espinales.
Resumen: La descripción de la morfogénesis de las 2 partes del SN explica en términos embriológicos que el SNC y el SNP son 2 sistemas separados, ya que cada uno se origina de una zona distinta de la placa neural, pero también que su separación anatómica no es total y que mantienen una constante interacción funcional.
Fases del Desarrollo del Sistema Nervioso
La morfogénesis se lleva a cabo por la sucesión de una serie de fases que requieren una gran precisión. Estas fases son secuenciales para cada célula, pero coexisten en el SN en desarrollo si se comparan células de diversas estructuras.
Proliferación celular
Es la fase en la que nacen las células (neuronas y células gliales) que componen el SN.
¿Dónde están las Madres? Zonas Proliferativas
Neuroepitelio: delgada capa de tejido que forma la pared del tubo neural en la 4a semana del desarrollo. Está formado por células germinales embrionarias llamadas células madre del SN (porque sólo originarán células nerviosas), que a partir del cierre del neuroporo rostral del tubo comienzan la fase de proliferación celular (gran actividad mitótica).

Durante la mitosis las células madre se sitúan en la zona ventricular mientras que en el periodo intermitótico ocupan la zona marginal. Esta distribución aporta al neuroepitelio una apariencia de estar formado por capas (pseudoestratificada).
De las divisiones rápidas de las células madre nacen células progenitoras que también se dividen con gran rapidez. Estas divisiones se producen en la zona ventricular del neuroepitelio. La zona marginal está formada por células en periodo de interfase. (Figura 8.13)
Las divisiones mitóticas de las células progenitoras originan en principio otras células progenitoras y, tras varias divisiones, éstas realizan una última división que produce neuronas inmaduras (no se dividen más) o glioblastos (si pueden dividirse durante toda la vida).

Muchos de los glioblastos que se originan en la zona ventricular se diferencian en un tipo de glía llamada glía radialque es característica de esta zona durante el periodo embrionario.
Gran parte de la proliferación celular se produce en la zona ventricular de las diferentes regiones del tubo neural:
– Zona ventricular: las células se dividen sucesivamente hasta que han proliferado una gran cantidad de las neuronas inmaduras que formarán las diferentes estructuras del SNC y muchos glioblastos (esto es lo visto hasta ahora).
Pero, hay otras zonas proliferativas:
- Zona Subventricular: Segunda zona proliferativa en el neuroepitelio del telencéfalo. Se forma sobre la zona ventricular con células progenitoras y glioblastos que se desplazan a ella en un periodo temprano del desarrollo y en ella nacen neuronas inmaduras de pequeño y mediano tamaño y la gran mayoría de las células gliales. Esta zona es además fundamental porque en ella nacen neuronas en la edad adulta.
- Capa granular externa: Segunda zona proliferativa del cerebelo. Se forma en la zona externa del neuroepitelio del cerebelo. En ella proliferan las neuronas inmaduras que se diferenciarán en células granulares y el resto de interneuronas del cerebelo. (La primera zona proliferativa del cerebelo es la típica zona ventricular del neuroepitelio del techo del IV ventrículo en la que proliferan las neuronas que se diferenciarán en células de Purkinje, células de Golgi y células de los núcleos profundos)
En el proceso de proliferación del tubo neural se originarán los distintos tipos de neuronas y células gliales que forman la sustancia gris y la sustancia blanca del SNC.
En el proceso de proliferación de la cresta neural se produce un proceso mitótico acelerado por el que se originan muchas células del SNP (todas las neuronas y la glía de los ganglios craneales y espinales, las células de Schwann y las células de los ganglios del SN autónomo).
¿Qué será: Neurona Inmadura o Glioblasto?

Distintas posibilidades respecto al origen de las neuronas inmaduras y los glioblastos. A. Las células progenitoras son pluripotenciales y generan indistintamente neuronas inmaduras y glioblastos. B. Sólo hay un tipo de cálulas progenitoras, que primero origina neuronas inmaduras, y después glioblastos. C. Actualmente se considera que existen dos tipos de células progenitoras, uno que origina las neuronas inmaduras y otro del que derivan los glioblastos, o sea, que la determinación proviene ya de las células progenitoras.
Tiempo de Nacimientos: Neurogénesis
Neurogénesis: nacimiento de las neuronas. Ocurre con la última división de las células progenitoras.
Un aspecto importante es que la neurogénesis no ocurre simultáneamente en las distintas zonas del tubo neural de modo que cada una tiene su propio periodo de neurogénesis. La mayor parte de la neurogénesis se produce en el periodo prenatal, pero hay excepciones:
– Neurogénesis postnatal. Ejemplo, en nuestra especie: las células granulares del cerebelo, hasta el séptimo mes de vida postnatal.
En cualquier región del tubo neural nacen antes las neuronas de proyección que las interneuronas (neuronas de circuitos locales).
Como cosecuencia de esta actividad proliferativa, la pared del tubo neural se irá engrosando y se formarán secuencialmente las distintas estructuras que componen el SNC.
Viajando a Casa: la Migración Celular

Las neuronas inmaduras se desplazan desde la zona en la que han nacido hasta su zona de destino. Al iniciar esta fase de migración las neuronas se sitúan entre la zona ventricular y la zona marginal del neuroepitelio y forman la zona intermedia o capa del manto, su ubicación en esta zona es transitoria porque prosiguen su desplazamiento hasta alcanzar su destino definitivo.
¿Qué tren tomar?: Mecanismos de Migración en el Tubo y Cresta Neurales
En el TUBO NEURAL la mayoría de las neuronas inmaduras migran guiadas por las células de glía radial que nacen en la zona ventricular al mismo tiempo que lo hacen las neuronas inmaduras.
– Función de la glía radial en la migración neuronal: es fundamental ya que sirven de soporte mecánico a las neuronas inmaduras para su desplazamiento a través del neuroepitelio.
Las neuronas en migración se desplazan por las prolongaciones gliales con un movimiento ameboide. Este mecanismo de migración, que conlleva la interacción entre las neuronas y la glía radial, está controlado por moléculas de la membrana celular.
– Las moléculas de adhesión celular neurona-glía (MAC-Ng):
• Realizan el reconocimiento de las prolongaciones de la glía radial para iniciar la migración, y
• Controlan la adhesividad de las neuronas migratorias a las mismas para permitir el desplazamiento de la neuronas.
Una vez terminada la migración, las células de la glía radial adquieren otras funciones.
El mecanismo de migración guiada desde la zona ventricular por la glía radial se considera universal para todas las células del SNC en desarrollo.
En la corteza cerebral, las neuronas migratorias se establecen en las capas siguiendo un patrón de dentro hacia afuera en relación con la fecha de su nacimiento, con una excepción: en la capa I, aunque es la más superficial, se instalan las primeras neuronas que nacen en el neuroepitelio telencefálico. Todas las neuronas de la placa cortical ascienden por las capas formadas antes, hasta alcanzar la capa I, y luego descienden hasta ocupar su capa.
En la corteza del cerebelo hay 2 patrones de migración (recordar que hay 2 zonas proliferativas):
- Las células que proliferan en la zona ventricular siguen la secuencia habitual de migración a través de la zona intermedia hasta situarse en su capa.
- Las células granulares del cerebelo, que proliferan en la capa granular externa, siguen la secuencia inversa, éstas migran guiadas por la glía radial desde la capa granular externa hasta alcanzar la localización en su capa.
Controversia ¿dónde finalizan su migración y establecen su destino las neuronas?:
– Teoría preformacionista: considera que el destino de las células está ya preestablecido antes de iniciar su migración
– Teoría epigenética (opuesta): la posición que toma una neurona al terminar su migración puede estar determinada por la interacción que establece con el entorno al que llega, con las células previamente establecidas.
Sin embargo, hay acuerdo en que terminan su migración cuando se altera la adhesividad de las células por cambios en la activación de las MAC, y por la participación de las moléculas de la matriz extracelular.
En la CRESTA NEURAL las células siguen un mecanismo diferente de migración ya que llegan a su zona de destino ayudadas por moléculas de la matriz extracelular.
El inicio de la migración de las células de la cresta neural lo determina la maduración de la matriz extracelular que la bordea. Estas células migran guiadas por las vías que establecen las moléculas de esta matriz y su destino depende totalmente de la ruta que ésta les marca.

Hay 2 vías de migración de las células de la cresta neural:
- Vía dorsolateral: las de la región craneal del embrión migran a través de una vía lateral bajo la superficie del ectodermo y la matriz extracelular que las guía determina que se diferencien en células no neurales.
- Vía ventromedial: las de la región del tronco lo hacen por una vía central que discurre entre el tubo neural y los somitas, y la matriz extracelular que las guía determina que se diferencien las distintas células del SNP y las células de la médula suprarrenal.
Durante la migración celular, en la superficie de la membrana de las células migratorias se activan receptores para las moléculas de adhesión celular; los cambios que se producen en éstos y en los componentes de la matriz extracelular, determinan si las células se adhieren con más fuerza entre sí o con las sustancias de la matriz extracelular, y si terminan o no la migración.
Cada población es distinta: la diferenciación neuronal y formación de las vías de conexión
Cuando la neurona termina su migración comienza a madurar. La maduración incluye su diferenciación y la fromación de las vías de conexión.
La diferenciación neuronal
En esta fase la neurona adquiere las características morfológicas y fisiológicas de la neurona madura (adulta).
La diferenciación morfológica básica de una neurona está programada antes de que alcance su destino, pero, el pleno desarrollo de su arborización depende del entorno de las neuronas y de las interacciones que se establecen entre ellas.
A partir de la semana 15 y después del nacimiento hay un segundo periodo de maduración que está relacionado con la formación de las vías de conexión y el periodo de establecimiento de conexiones que son fundamentales para la completa diferenciación neuronal.
La maduración de la neurona implica, además de unas características morfológicas, la adquisición de propiedades fisiológicas específicas.
Los impulsores del urbanismo neural: el cono de crecimiento y los factores que guían los axones hacia sus destinos
El complejo proceso de crecimiento de la neurona inmadura depende de los conos de crecimiento. Éstos existen en todos los extremos de las prolongaciones neuríticas (axones y dendritas) que están desarrollándose y son los que propulsan su crecimiento.
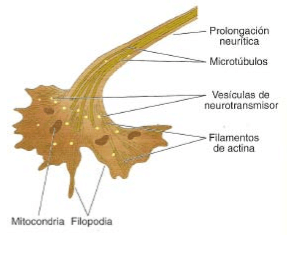
Los conos de crecimiento extienden y retraen los filopodia (simple extensión del terminal a modo de dedo) que se agarran al substrato en el que crecen y tiran del cono de crecimiento, promoviendo a su vez el estiramiento de las neuronas (axones y dendritas). Estos movimientos del cono están controlados por el citoesqueleto celular.
Otro de los objetivos de los movimientos del cono es captar del entorno neuronal nuevo material de carácter nutritivo para promover el crecimiento global de la neurona. Estas sustancias que favorecen el crecimiento de las prolongaciones se llaman sustancias neurotróficas. La primera sustancia neurotrófica se descubrió en el SNP y se denominó factor de crecimiento nervioso (FCN).
Los factores que contribuyen a guiar los axones hacia sus destinos implican tanto procesos de reconocimiento molecular o de afinidad química como soportes de tipo mecánico.
Proceso de afinidad química (propuestas):
- Desde las zonas de destino (dianas) de los axones emanan sustancias que los dirigen hacia ellas. Estas sustancias con esta capacidad directriz se denominan sustancias neurotrópicas. (Propuesto por Ramón y Cajal)
- Hipótesis de la quimioafinidad. Según esta hipótesis cada célula tiene su propia señal de identificación química y sus axones en crecimiento se dirigen hacia señales complementarias específicas liberadas por las neuronas con las que contacta. (Propuesto por R. Sperry, menos aceptada)
Soportes mecánicos: Se ha comprobado que los axones se dirigen a sus blancos (estructuras de destino) guiados de diversos modos por soportes mecánicos del entorno en el que crecen. Este entorno lo proporciona la matriz extracelular, y parece que en ella se pueden establecer rutas o senderos que guían los axones a sus destinos y repelen e impiden la extensión de otros axones próximos.
El balance que se establece entre las distintas moléculas de la matriz extracelular va cambiando durante el recorrido del axón y cuando el axón llega a su destino un nuevo entorno extracelular puede señalar la detención del crecimiento del axón. Este es
un mecanismo útil para los primeros axones que crecen en una estructura (axones pioneros). Los que crecen posteriormente pueden seguir las rutas marcadas por estos pioneros o agruparse en torno a éstos y a otros para dirigir su crecimiento. Este mecanismo se denomina fasciculación (viajar juntos) y se apoya en las propiedades de adhesión de las MAC.
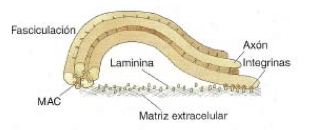
Control de poblaciones: supervivencia y muerte neuronal
En todo el SNC se produce una neurogénesis excesiva: Un gran número de las neuronas que nacen en el proceso de neurogénesis, aunque se diferencien y completen el crecimiento de sus axones y éstos lleguen a sus destinos, afrontan una batalla en la que mueren.
Esta muerte celular natural llamada apoptosis o muerte celular programada (porque está dirigida genéticamente) sucede en cantidades importantes durante el desarrollo normal, con una tasa entre el 25%-75% de las poblaciones iniciales y ocurre en el último periodo prenatal y en el periodo postnatal temprano.
La muerte neuronal es una fase del desarrollo tan importante como la neurogénesis. Es el mecanismo que permite controlar y establecer las poblaciones neuronales realizando un ajuste adecuado entre las poblaciones que emiten axones (presinápticas) y las poblaciones diana (blanco) que los reciben (postsinápticas).
Factores implicados en la supervivencia neuronal
LAS DIANAS DE LOS AXONES son uno de los factores implicados en la determinación de las poblaciones neuronales.
– Experimentos ya clásicos en la investigación del desarrollo demostraron que las motoneuronas que no podían realizar sinapsis porque se eliminaban sus células diana antes de que sinaptaran sobre ellas, morían. También demostraron que si el área diana de los axones aumentaba, se reducía la muerte.
La explicación respecto a qué podían proporcionar estas diana para promover la supervivencia de las neuronas llegó con el descubrimiento del FCN, la primera sustancia neurotrófica conocida.
Teoría neurotrófica: las neuronas nacen en cantidades muy superiores a las necesarias y deben competir entre ellas para obtener el factor trófico (el FCN) que es producido en cantidades limitadas por las células diana con las que establecen contactos. Este factor trófico de las dianas actúa retrógradamente en las neuronas promoviendo su mantenimiento y supervivencia de modo que sobreviven las que tienen más acceso a él. (supervivencia de las más aptas, símil con la selección natural)
La familia de los factores neurotróficas o neurotrofinas tiene una importancia crucial para la supervivencia neuronal porque las neuronas que no obtienen una cantidad suficiente de estas proteínas se ven abocadas a la muerte (Fig. 8.31).
LOS AXONES AFERENTES Y LAS SINAPSIS que establecen las neuronas con las Dianas.
Cuando los axones en crecimiento llegan a sus diana establecen contactos con las neuronas del mismo. En estos puntos de contacto entre los axones aferentes y las neuronas de destino, se forman unas estructuras especializadas en la transmisión de señales neurales, denominadas sinapsis. El período en el que se forman las sinapsis se denomina sinaptogénesis, el cual comienza muy pronto en el desarrollo; de modo que, mientras unas neuronas están proliferando, otras ya están formando sinapsis.
Tanto en el SNC como en el SNP, la sinaptogénesis se lleva a cabo en dos fases:
1. Fase de sobreproducción en la que se forman numerosas sinapsis provisionales.
2. Fase en la que se eliminan muchas de las que se realizaron inicialmente y se reorganizan las restantes.
Primero se forman sinapsis sobre las dendritas de las neuronas diana y más tarde se forman las sinapsis sobre los cuerpos celulares.
Resultados de diversos experimentos indican que las conexiones sinápticas que se establecen sobre una diana regulan la cantidad de neurotrofina que ésta produce y, por tanto, la cantidad que estará disponible para ser captada por los terminales que llegan a ella. En este sentido, cuantas más sinapsis se establecen en una diana mayor es la posibilidad de que sobrevivan las neuronas que establecen sinapsis con ella (Fig. 8.31).

Se ha demostrado que los terminales presinapticos (aferentes) son muy importantes para la supervivencia de las neuronas postsináptica (diana), ya que si se elimina se produce un gran aumento de muerte neuronal en las dianas; la magnitud el efecto es diferente dependiendo del período en que se eliminen las aferencias.
FACTORES ENDOCRINOS donde están implicadas hormonas gonadales o sexuales.
Estas hormonas son fundamentales durante el desarrollo perinatal (se define como el período que comprende desde la 22 semanas de gestación (154 días) hasta el término de las primeras 4 semanas de vida neonatal (28 días) porque establecen las diferencias morfológicas y fisiológicas del SN que subyacen a las diferencias conductuales características de cada género.
Hipótesis de la organización: planteaba que en el desarrollo perinatal los andrógenos (hormonas masculinas) diferencian los tejidos neurales responsables de la conducta reproductora. Se ha visto así, la importancia de estas hormonas como factores epigenéticos del desarrollo.
En diferentes especies, incluida la humana, el SN tiene características dimórficas entre los géneros, influyendo sobre las poblaciones neuronales. Este dimorfirmo sexual depende de los efectos organizadores que ejercen las hormonas sexuales en periodos perinatales (cuando se produce la muerte celular programada), críticos para el desarrollo neural. El entorno hormonal al que está expuesto el SN en el periodo perinatal favorece o perdujica la supervivencia neuronal estableciendo diferencias entre las poblaciones neuronales de ambos sexos (se puede observar en las estructuras sexualmente dimórficas de los circuitos neuronales que controlan las conductas reproductoras en mamíferos).
Se remodelan las vías de conexión
Después de que se han ajustado las poblaciones neuronales el SN experimenta durante el periodo postnatal un remodelado que es fundamental para su funcionamiento, que incluye:
Una gran eliminación de sinápsis establecidas previamente (por falta de precisión en la inervación o porque la célula diana recibía un número erróneo de aferentes).
Una causa de eliminación de sinápsis es la muerte neuronal, como se ha visto, al desaparecer los contactos que habían formados. Pero hay otros factores que provocan posteriormente una gran pérdida de contactos sinápticos, como la eliminación de colaterales de axones en determinadas zonas como el cuerpo calloso. Se produce una “poda” de muchos colaterales y se eliminan sus contactos sinápticos.
Y una reorganización de los contactos que establecen los terminales que permanecen.
El proceso de remodelación sináptica coincide con el comienzo de la actividad neuronal y se ha comprobado que la actividad sináptica es fundamental para que se mantengan las conexiones neurales ya que las que no se usan o se usan a destiempo se eliminan.
Hipótesis de la competencia: los aferentes que llegan a una diana compiten entre sí y sólo establecen contactos fuertes los que tienen mayor actividad. Hubel y Wiesel en la década de 1960 indicaron que la fuerza de la sinapsis depende de su coactivación, de manera que las sinapsis coactivas se hacen estables, mientras que las que están inactivas (especialmente cuando otras están activas), se debilitan y son eliminadas.
Estos experimentos dieron soporte al concepto de plasticidad neuronal, o capacidad de cambio, de adaptación del SN. Mostraron que la estimulación sensorial en periodos críticos del desarrollo es fundamental para la configuración de los contactos sinápticos, aunque en el SN también se produzca actividad espontánea la cual intervienen en la remodelación sináptica.
En general, en el encéfalo humano durante los primeros 4 años después del nacimiento aumenta progresivamente el número de contactos sinápticos en respuesta a la actividad neuronal, y a partir de ese periodo y hasta la pubertad se produce una gran reorganización sináptica, pero los periodos concretos de remodelación son propios de cada región.
La reorganización sináptica aporta precisión y eficiencia de los contactos sinápticos porque se eliminan muchos de los que no se han utilizado y son superfluos, y se preservan sólo los que han mostrado su eficiencia en la actividad neural. También reduce su gasto energético general, permitiendo que pueda disponer de más energía para la actividad de los circuitos neurales que son esenciales.
Por lo tanto, el periodo postnatal, la primera infancia en humanos, es un periodo en el que las experiencias que vive cada individuo, marcarán el destino que sus contactos sinápticos tendrán más adelante.
El SN conserva una capacidad de cambio que permite afinar los circuitos de un modo muy preciso para lograr su funcionamiento óptimo en un entorno cambiante. Estos períodos en el que el SN es vulnerable a influencias que están más allá de la programación intrínseca (genética) del desarrollo se denomina período crítico o período de máxima susceptibilidad. Además de la experiencia, otros factores epigenéticos influyen sobre las distintas fases del desarrollo del SN, como las hormonas gonadales, la administración de sustancias adictivas (alcohol, drogas, tabaco), los ambientes enriquecidos o empobrecidos, la nutrición, etc.
¿Hasta cuando la remodelación?
Cuando los axones han terminado su periodo de crecimiento, han emitido sus colaterales y han consolidado sus conexiones comienza el proceso de mielinización.
Ésta se da desde el periodo prenatal hasta bien entrada la edad adulta (no termina antes de los 30 e incluso 50 años). Ocurre en ciclos, con una consecuencia ordenada predeterminada, en dirección caudo-rostral.
Diversas investigaciones apuntan que la mielinización se desencadena con el comienzo de la actividad neural y que es un proceso dependiente de la experiencia. Se ha demostrado que la extensión de la sustancia blanca varía entre diferentes sujetos en función de la experiencia y del entorno cambiante en el que se desarrollan. Cambia con las destrezas que se adquieren (ejemplo de un pianista experto con más sustancia blanca en determinadas regiones del encéfalo y con axones con más mialina). En niños que crecen en ambientes empobrecidos el cuerpo calloso es hasta un 17 % más pequeño que lo normal, y al contrario.
La experiencia influye en la mielinización, y la mielinización influye en la capacidad funcional del SN, en el aprendizaje y en la adquisición de destrezas. La mielinización es un proceso fundamental del desarrollo del SN porque la mielina aumenta la velocidad de conducción de las señales neurales por el axón.
Sin embargo, la mielinización también aporta cierta rigidez a los circuitos neuronales, lo que limita la formación masiva de sinapsis. La mielina contiene una proteína que impide que los axones se ramifiquen y establezcan nuevas conexiones. Destrezas como tocar un piano o aprender idiomas sólo se adquieren bien si se aprenden antes de que termine la mielinización de los circuitos neurales implicados.
No obstante, el SN adulto sigue manteniendo capacidad de cambio. Sigue produciéndose sinaptogénesis en la edad adulta, aunque a niveles bajos; ocurre reorganización sináptica. Esta capacidad de que en los contactos sinápticos se produzcan cambios que reflejan las experiencias vividas y que permiten la adaptación al entorno cambiante se denomina plasticidad neural, y aunque es mayor en la infancia, se mantienen durante toda la vida. Desde hace unos años se están dando a conocer los primeros datos que confirman que en primates adultos, incluido el hombre, se siguen generando neuronas (a partir de células madre) en el giro dentado del hipocampo y en la zona subventricular del encéfalo anterior.
De modo general se puede decir que los factores genéticos establecen una organización básica, que dirige el desarrollo del SN basándose en la superabundancia. En el periodo perinatal y la primera infancia, la interacción con el ambiente interno del organismo y las experiencias que afronta el SN producirán cambios en la estructura inicial, que serán fundamentales para configurar la organización anatomofuncional del SN de cada individuo. Su organización madura, no obstante, seguirá conservando capacidad de cambio durante el resto de la vida, lo que permitirá aprender, recordar o recuperar funciones tras lesiones o accidentes. Todo esto demuestra que el SN está bien adaptado para enfrentarse a un entorno de cambio constante.
